
遗传密码,贯穿古今,记载物种间的竞争与交融,整合人类基因组的远古病毒遗传物质如何介导衰老发生,单分子FISH技术高保真透视细胞内分子互作动态,助力衰老发生机制研究。
2023年1月6日,中国科学院动物研究所刘光慧、曲静课题组和中国科学院北京基因组研究所张维绮课题组合作发表“Resurrection of endogenous retroviruses during aging reinforces senescence”重要研究论文,揭示内源性逆转录病毒(ERVs)的激活是细胞衰老和组织老化的标志和驱动力,并在抑制ERVs后细胞衰老及组织退化甚至是机体衰老可得到缓解。该突破性研究成果发表在知名杂志Cell。中国科学院动物研究所助理研究员刘晓倩、博士研究生刘尊鹏、特别研究助理武泽明和中国科学院北京基因组研究所研究员任捷为文章并列第一作者。

基因组中休眠的病毒起源转座元件如内源性逆转录病毒(ERVs)是否或如何被唤醒并促进老化过程,在很大程度上是未知的。在人类衰老细胞中发现了整合的内源性逆转录病毒HERVK (HML-2)能够被解锁,从而转录病毒基因并产生逆转录病毒样颗粒(RVLPs)。这些HERVK RVLPs构成了在年轻细胞中诱导衰老表型的可传递信息,且这个过程可通过中和抗体来阻断。在老年灵长类动物和小鼠的器官以及老年人的人体组织和血清中也观察到了ERVs的激活。抑制ERVs可以缓解细胞衰老和组织退化,在某种程度上还可以缓解机体衰老。这些发现表明,ERVs的复活是细胞衰老和组织衰老的标志和驱动力。
原文链接:https://doi.org/10.1016/j.cell.2022.12.017
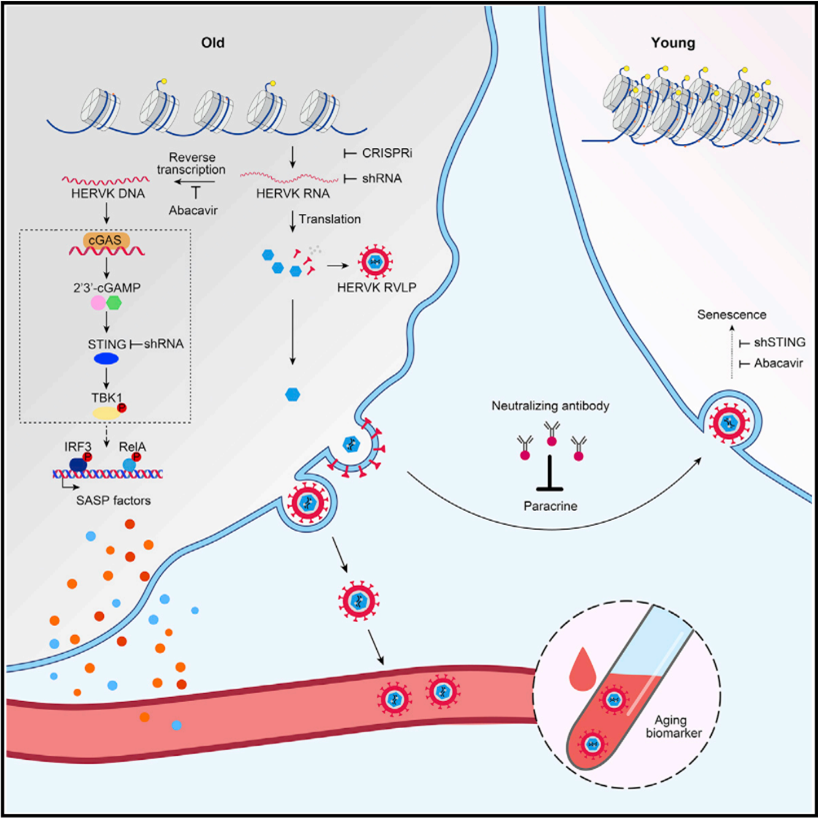
研究人员运用高通量链特异性转录本测序、全基因组DNA甲基化测序、高分辨率单分子RNA/DNA原位杂交、免疫电镜和高灵敏的液滴数字PCR等多学科技术,通过建立不同衰老模型,发现衰老细胞中表观遗传去抑制(如异染色质减少)导致基因组中ERVs的转录激活并翻译出病毒蛋白,进而包装成病毒颗粒。一方面,衰老细胞中ERVs的反转录产物通过激活cGAS-STING天然免疫通路诱发细胞衰老和炎症;另一方面,衰老细胞释放的ERVs病毒颗粒可通过旁分泌或体液介导的方式在器官、组织、细胞间有效传递并放大衰老信号,最终使得年轻细胞因受“感染”而老化。
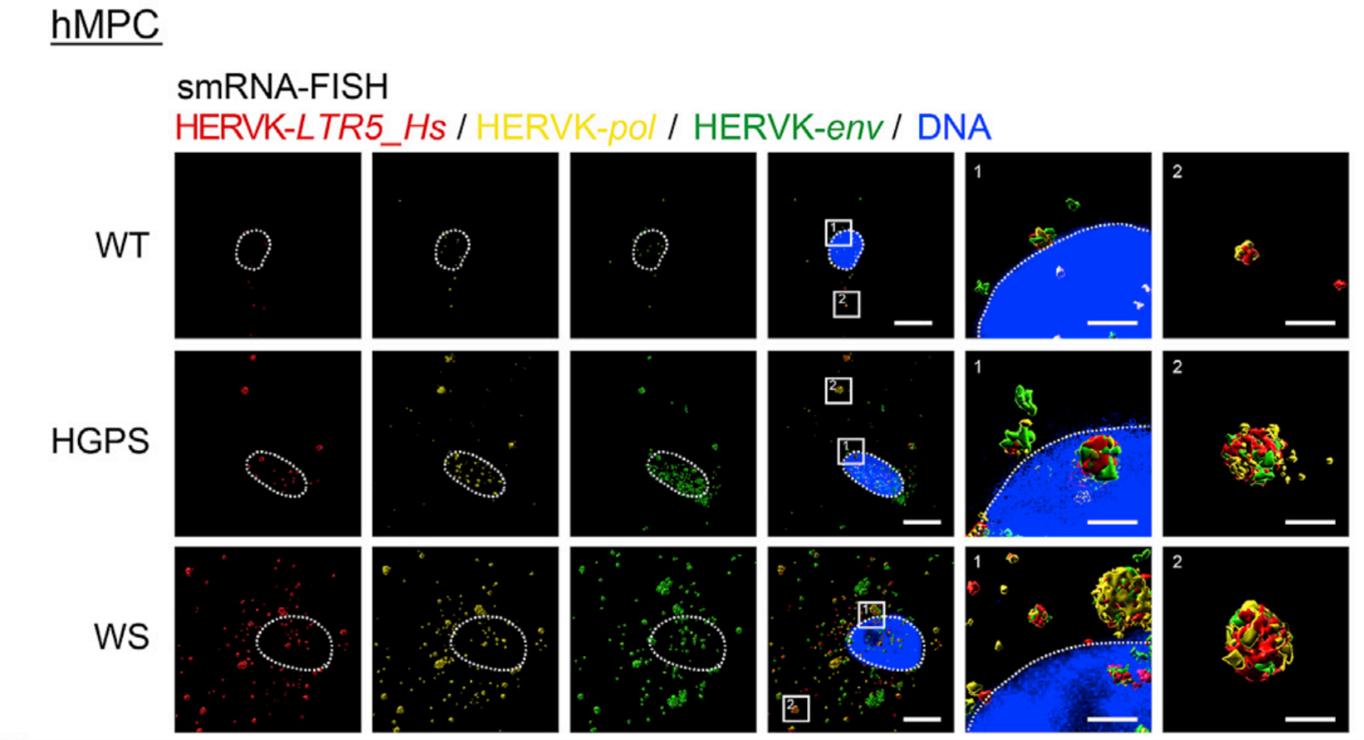
图1 利用单分子FISH在衰老的hMPCs中检测逆转录元件定位情况
鲲羽生物(Spatial FISH)在本研究中,提供了专业高精度的单分子RNA-FISH (smRNA-FISH)检测探针,用不同的荧光探针实现了LTR5_Hs、env和pol的定性定位解析,证明了LTR5_Hs (HERVK的转录调控区域)、env和pol的mRNA分子存在于衰老的hMPCs中。论文多处使用鲲羽生物原位杂交探针从DNA和RNA层面上进行检测,在细胞内分子调控机制研究中发挥至关重要的作用。
本研究为理解衰老机制提供新的见解,丰富了程序化衰老理论。为理解衰老的“传染性”机制奠定了基础,为建立评估衰老的科学方法和开发缓解衰老的临床策略开辟了新途径。
鲲羽生物研发团队专注于高灵敏度、单细胞精度、多基因原位杂交技术、原位测序空间组学技术的研发与应用,拥有20余年基因原位杂交和10年空间组学研发经验,可为您的研究提供国际一流品质的定制化原位杂交试剂盒和超高分辨率空间组学服务,完整再现基因的空间转录图谱与细胞空间构筑!
公司秉承助力科学探索,普惠百姓健康,崇尚科技创新,立足产业兴国的愿景,为科研和临床提供更好的产品与服务,推动民族生物原始创新技术走向世界、服务全球!